Continuamos completando la Tabla periódica de El Tamiz. Tras hablar del nitrógeno en la entrada anterior de la serie Conoce tus elementos, hoy nos dedicaremos a otro elemento común (y cuya historia está muy relacionada con la del nitrógeno, de modo que si no recuerdas ese artículo no estaría de más releerlo): el oxígeno.
¿Sabías que el nombre de este elemento no tiene mucho sentido, sabiendo lo que sabemos hoy en día? ¿Y que en determinadas concentraciones es tóxico? ¿O que no siempre es transparente en estado puro? Zambullámonos en este elemento cotidiano pero, en algunos aspectos, no muy conocido.
En la entrada acerca del nitrógeno ya hablamos de los esfuerzos de los químicos del siglo XVIII por determinar los componentes del aire atmosférico. Algunos de los alquimistas más avanzados ya sabían que la atmósfera estaba compuesta de sustancias más sencillas: en el siglo XVI, Michał Sędziwój había obtenido un gas a partir de la sal pétrea, y había observado que este gas era necesario para la vida y que se encontraba en el aire. El alquimista y filósofo polaco llamó a este gas “elixir de la vida”. Hoy sabemos que lo que había observado era oxígeno (aunque la metodología que seguía, así como sus conclusiones, no eran tan rigurosas como las de los químicos del XVIII).
Como dijimos en el artículo anterior, Joseph Priestley dividía el aire en una parte que contenía flogisto (no podía arder ni sustentar la vida), llamada por él aire flogistizado (que estaba formado fundamentalmente por nitrógeno), y otra parte que no contenía flogisto (que podía hacer arder sustancias “flogistizadas” al aceptar su flogisto), a la que llamaba aire desflogistizado. Naturalmente, el aire desflogistizado de Priestley no era otra cosa que el elixir de la vida de Sędziwój: oxígeno.
Por cierto, el farmacéutico sueco Carl Wilhelm Scheele había descubierto el oxígeno independientemente de Priestley y un par de años antes que él, obteniéndolo de idéntica manera (calentando óxido de mercurio), pero el sueco no publicó sus resultados hasta después que el inglés, de modo que Priestley se lleva los honores de ser el primero en describir científicamente el elemento. (Esto puede parecer injusto, pero reconocer al primero en publicar un descubrimiento motiva a los científicos a compartir sus descubrimientos lo más rápido posible, lo cual facilita el desarrollo de la Ciencia). Scheele llamaba al gas “aire de fuego”, por razones obvias.
Sin embargo, fue el francés Antoine Laurent Lavoisier el que dio el nombre al elemento. En aquella época, los químicos pensaban que todos los ácidos contenían el “aire de fuego” o “aire desflogistizado”, de modo que Lavoisier decidió llamar al elemento “generador de ácidos” - en griego, oxígeno. Desafortunadamente, esa teoría de los ácidos no era correcta: hoy sabemos que hay muchos ácidos que no contienen oxígeno (por ejemplo, el que digiere los alimentos en nuestro estómago, el ácido clorhídrico, que tiene únicamente hidrógeno y cloro)… El oxígeno no es el único generador de ácidos (no es el único “oxígeno”) pero, como suele ocurrir, una vez que algo se nombra y el nombre es generalmente aceptado, es muy difícil cambiarlo, de modo que nos hemos quedado con el erróneo oxígeno.
¿Qué hace especial a este elemento? Un átomo de oxígeno tiene ocho electrones. Como recordarás, la primera capa electrónica puede contener dos, de modo que el oxígeno tiene seis en la segunda capa. Puesto que dicha capa puede contener ocho electrones, el oxígeno está ávido de captar un par de electrones extra para tener ocho en la última capa y ser estable. Como el oxígeno tiene tanta “hambre de electrones”, cuando reacciona con otros elementos suele quitarles electrones: el oxígeno los gana, y el otro elemento los pierde.
Naturalmente, hay muchos otros elementos que hacen esto además del oxígeno, pero como este elemento es tan abundante y es tan evidente su “hambre de electrones”, al proceso de quitar electrones a algo se le llama oxidarlo. Se dice que el oxígeno se reduce, mientras que el otro elemento se oxida. ¡Pero este nombre, como todos los demás, es arbitrario! Como hay tantas reacciones en las que el oxígeno hace esto sobre otros elementos, ha otorgado su nombre al proceso.
Y es que gran parte de la importancia del oxígeno es su abundancia. Recordarás que el hidrógeno es el elemento más común del Universo, y el helio el segundo. Bien, el oxígeno es el tercer elemento más común: alrededor del 1% de la masa del Universo es oxígeno. Esto puede parecer poco, pero es que si quitas el hidrógeno, el helio y el oxígeno, ¡sólo queda otro 1% del Universo! De modo que hay tanto oxígeno como todos los demás elementos juntos salvo el hidrógeno y el helio.
La razón de su abundancia es que el oxígeno es el producto (final o intermedio) de varios procesos de fusión en las estrellas. Parte de él se produce en el ciclo CNO de producción de helio (en un paso en el que se fusionan nitrógeno e hidrógeno para producir oxígeno), pero la mayor parte se produce en estrellas muy masivas en las que se fusionan carbono (dos átomos de carbono se convierten en uno de oxígeno y dos de helio) o neón (un átomo de neón recibe un fotón muy energético y se desintegra en un átomo de oxígeno y otro de helio). Al haber nacido nuestro Sol de las “cenizas” de estrellas anteriores, nuestro sistema solar es rico, entre otras cosas, en oxígeno - mucho de él en nuestra atmósfera, disponible para los seres vivos.
Por eso el oxígeno es tan importante para nosotros: lo utilizamos para obtener energía de los alimentos. Eso es, dicho mal y pronto, la respiración: coger oxígeno, coger otros elementos, y usar el oxígeno para oxidarlos y producir energía. Como muchos otros seres vivos, hemos “elegido” el oxígeno porque es muy abundante en forma pura en nuestro entorno (en el aire), pero existen seres vivos que no utilizan el oxígeno para oxidar (porque no existe en forma pura en su entorno), sino otros elementos, como el azufre. Otros seres vivos, como los peces, aprovechan el oxígeno que se disuelve en el agua desde la atmósfera (que no es mucho, pero les basta). Ya hemos hablado de cómo mucha gente cree que los peces respiran el “O” del “H2O”, y cómo esto no es cierto, en una Falacia de hace un tiempo.
Estamos rodeados de oxígeno en su alótropo más común, la molécula diatómica O2. Alrededor del 21% de la atmósfera es oxígeno molecular, que es un gas transparente (de modo que no voy a mostrarte una foto). Sin embargo, puede que no sepas que el oxígeno líquido (y el sólido), a diferencia del gaseoso, tienen un hermoso color azulado:
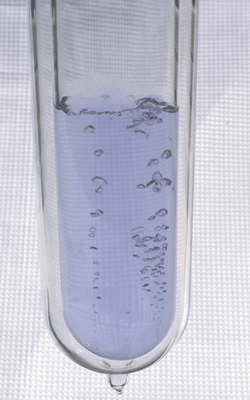
Oxígeno líquido.
Otro alótropo muy conocido del oxígeno es el ozono, compuesto por tres átomos de oxígeno (O3). El ozono es inestable, de modo que no suele encontrarse fácilmente porque se acaba descomponiendo para producir, finalmente, oxígeno diatómico. Sólo hay ozono en cantidades apreciables en sitios en los que se produce continuamente (la estratosfera, en la que se forma gracias a la radiación ultravioleta, y cuando la luz solar incide sobre algunos hidrocarburos y óxidos de nitrógeno al nivel del suelo, generalmente componentes de la contaminación atmosférica). Irónicamente, el ozono es esencial para nosotros, porque nos protege de la radiación ultravioleta del Sol, pero es muy tóxico (es un oxidante más potente aún que el oxígeno diatómico). De modo que el ozono es “bueno, pero lejos”.
Este carácter fuertemente oxidante del ozono lo hace útil por su propia toxicidad para la vida: se emplea para esterilizar, por ejemplo, agua. En un tiempo bastante corto el ozono desaparece, pero para entonces ha acabado con los microorganismos que pudiera haber en el agua. La desventaja de este sistema respecto a otros más empleados, como la cloración, es que una vez el ozono se ha desvanecido las bacterias pueden volver a proliferar en el agua.
¡Pero es que incluso el bienamado O2 puede ser tóxico! Como hemos dicho, es el elemento que da el nombre a la oxidación, por ser un oxidante tan potente (y abundante). De modo que, si el ozono es “bueno, pero lejos”, el oxígeno diatómico es “bueno, pero poco”. Si tu sangre contiene demasiado oxígeno, se produce lo que se denomina hiperoxia. Aunque nuestro cuerpo tiene defensas contra el poder oxidante del oxígeno (de modo que oxida sólo lo que queremos que oxide), si la concentración es suficientemente grande las defensas del organismo no pueden con él, y se producen daños en las células.
Naturalmente, esto no va a pasarte salvo que respires aire que está a una presión muy elevada, o que contenga una concentración de oxígeno anormalmente alta: no hay por qué preocuparse salvo en situaciones especiales. Puede ocurrir, por ejemplo, si buceas y respiras una mezcla determinada a una profundidad mayor que la recomendada para esa concentración de oxígeno.
Por otro lado, es una idea muy común que la “hiperventilación” es un problema debido a que hay demasiado oxígeno en la sangre, pero eso no es cierto: alguien hiperventilado no tiene demasiado oxígeno en la sangre, sino demasiado poco dióxido de carbono (de ahí el respirar dentro de una bolsa y cosas parecidas).
De manera que el oxígeno es especial porque, además de ser un potente oxidante, es muy común en la naturaleza en forma pura: es el “oxidante por antonomasia”. Y su importancia para nosotros reside, naturalmente, en que sin el no podríamos respirar, de modo que no podríamos obtener energía de los alimentos y moriríamos. Un elemento cotidiano, pero aun así, interesante. Sin embargo, hay otro elemento aún más hambriento de electrones que el oxígeno - irónicamente, no es el oxidante más potente. En la próxima entrada de la serie hablaremos de ese elemento: el flúor.