Nuestra última parada en la serie de Conoce tus elementos, en la que recorremos poco a poco la tabla periódica, fue el elemento de treinta y cuatro protones: el selenio. Como recordarás se trataba de un elemento que podía formar gases hediondos y peligrosos – hoy veremos otro aún más fétido y repugnante, pero al mismo tiempo muchísimo más bello. Hablaremos de solubilidad, de caracoles y emperadores, de la edad de los océanos y, a través de ellos, del elemento de treinta y cinco protones, el bromo.
Hay muchas similitudes en las historias del selenio y el bromo: ambos son muy poco comunes en la corteza terrestre, ambos son muy reactivos –el bromo aún más que el selenio– con lo que es casi imposible encontrarlos puros. Esto significa que hoy, una vez más, hablaremos de un elemento que descubrimos hace muy poco tiempo, en la última parte de la “fiebre descubridora” de los siglos XVIII-XIX.
Lo mismo que el selenio, el bromo no forma compuestos en grandes cantidades en las rocas, sino que está “difuso”, formando parte de rocas de otros compuestos en las que es una impureza de concentración minúscula. Aunque no es tan escaso como el selenio, sólo hay un 0,006 5 % en masa en la corteza terrestre. Podrías pensar que, igual que con el selenio, nunca tuvimos contacto con cantidades razonables de bromo hasta el siglo XIX, pero no fue así.
La razón es que hay una diferencia química fundamental entre el selenio y el bromo, una diferencia con importantísimas consecuencias sobre nuestra relación con ambos: la solubilidad en agua.
El bromo está a tan sólo un electrón de completar una capa electrónica, es decir, a punto de ser estable. Y ya hemos visto lo que esto significa a lo largo de la serie: el bromo es enormemente inestable ya que es muy electronegativo, es decir, tiene una hambre voraz de electrones. Esta electronegatividad hace que se asocie bastante fácilmente a los átomos de hidrógeno de la molécula de agua, con lo que se disuelve estupendamente en ella.
¿Y qué importa que se disuelva bien en agua o no?, puedes pensar. Pues importa, y mucho. Pero para entender por qué, retrocedamos unos cuantos miles de millones de años en el tiempo, e imagina el ciclo del agua que te explicaron en el colegio: el agua se evapora de los océanos, forma nubes, la lluvia cae sobre el suelo, forma ríos que van otra vez al mar, bla bla bla…
Pero cada vez que el agua recorre el ciclo arrastra minerales al océano, y cuando se evapora para formar nubes de nuevo los minerales no lo hacen con ella, sino que permanecen en el océano. Esto supone que con el paso de los eones los océanos se hacen más y más salados, y que se depositan en el fondo grandes cantidades de minerales no solubles.

Bromo… ¡bromo por todas partes! (dominio público).
Los iones disueltos más comunes en el agua de los océanos son, por tanto, los que más abundantes son en las rocas y más solubles en agua son (ya que de otro modo hubieran acabado en el fondo): iones de potasio, K+, de sodio, Na+, de cloro, Cl-… y, aunque en menor cantidad, de bromo, Br-. Es cierto que las sales de bromo existen en las rocas en cantidades minúsculas, pero también lo es que llevan siendo arrastradas y disueltas en el agua de los océanos desde hace miles de millones de años.
¿Por qué te cuento todo esto? Porque es importante entender que, aunque en una concentración relativamente pequeña, existe bromo disuelto en el agua de los océanos. Al tratarse de una concentración muy pequeña no fuimos conscientes de que estaba allí durante mucho tiempo, pero otros seres vivos ya habían evolucionado para emplearlo: y fueron esos seres vivos quienes nos lo enseñaron, en cierta manera.
Ya he dicho antes que el bromo es muy electronegativo. Esto hace que sea un oxidante muy eficaz, ya que oxidar significa, dicho mal y pronto, robar electrones, y no hay cosa que le guste más al bromo que eso. No es un oxidante tan bueno como el cloro, el oxígeno o el flúor, pero sigue siendo estupendo. Esto significa que puede actuar como antimicrobiano, y que en grandes concentraciones puede ser tóxico.
Varias especies de caracoles marinos, por lo tanto, han evolucionado para hacer uso del bromo. Estos caracoles fabrican moléculas que contienen varios átomos de bromo y que emplean como sustancias antibacterianas para cubrir los huevos, o como mecanismo de defensa ante depredadores. Y aunque hay varias moléculas de este tipo con diferentes propiedades –dependiendo de la cantidad de bromo y los otros átomos que forman parte de ella–, elaboradas por distintos caracoles, uno de estos grastrópodos elabora una que es especial.

Bolinus brandaris, antes Murex brandaris (H. Zell / CC Attribution-Sharealike 3.0 License).
Se trata del caracol Bolinus brandaris, antiguamente llamado Murex brandaris. Curiosamente no es que este caracol fabrique una sustancia de extraordinarias propiedades antibacterianas, ni especialmente tóxicas, ni nada parecido. Por casualidades de la vida, la molécula que fabrica el B. brandaris, el 6,6’-dibromoíndigo, compuesta por átomos de carbono, hidrógeno, oxígeno, nitrógeno y dos átomos de bromo, uno en cada extremo, además de sus propiedades químicas “normales” tiene un color absolutamente maravilloso y un comportamiento aún más maravilloso si se emplea como tinte.
El caracol fabrica esta molécula en la glándula hipobranquial, el mismo órgano que, modificado, produce la tinta en los calamares y las sepias. De hecho, el comportamiento en este caso es similar: cuando el caracol se ve amenazado, suelta una sustancia viscosa y de color oscuro segregada por la glándula hipobranquial. Pero, a diferencia de la tinta de los calamares, la sustancia segregada por el Bolinus brandaris tiene un color tan bello que llamó la atención de los primeros pescadores que lo hallaron en el Mediterráneo.
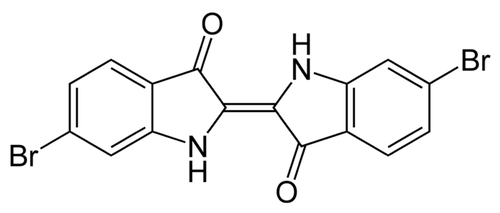
6,6’-dibromoíndigo (dominio público).
Ya en la Antigüedad se capturaban enormes cantidades de estos moluscos para extraer de ellos la sustancia viscosa; la leyenda decía que el perro de Heracles se había manchado el morro al comer caracoles en la playa, y así fue como Heracles descubrió la existencia de esta sustancia. Desde luego nadie sabía que la molécula que la hacía especial era 6,6’-dibromoíndigo, sino que era conocida como púrpura de Tiro, ya que los fenicios de aquella ciudad comerciaban con ella y pedían a cambio cantidades exorbitantes: valía su peso en plata. Antes que ellos sabemos que los cretenses habían extraído ya esta “tinta de caracol” del Bolinus brandaris porque aún quedan montañas de conchas trituradas.
Aunque, como digo, los comerciantes tirios exigían precios enormes por esta sustancia, la gente se pegaba por pagarles lo que pidieran. En primer lugar, el tinte púrpura obtenido de este caracol era de un color intenso y bellísimo, imposible de imitar de ninguna otra manera: algo nada sorprendente, dada la enorme escasez del bromo en cualquier otra parte de la Tierra, ¡hace falta un caracol que lo vaya absorbiendo del agua marina a lo largo de su vida!

Púrpura de Tiro en polvo y tiñendo una tela (www.versuchschemie.de / CC Attribution-Sharealike 3.0 License ).
Pero lo especial de la púrpura de Tiro no era sólo su color magnífico y brillante, en una época en la que los tintes tan bellos eran rarísimos: era su comportamiento después de teñir un tejido. Los tintes toman su color, naturalmente, de las moléculas que contienen (como la que nos ocupa ahora), y esas moléculas suelen oxidarse en contacto con el aire, o más comúnmente reaccionar ante la radiación solar e ir cambiando de color con el tiempo hasta hacerse mucho menos brillantes. Si alguna vez has dejado una fotografía al sol unos cuantos años, sabes de lo que hablo.
Pero el 6,6’-dibromoíndigo no pierde su brillante color al exponerse al aire y el Sol, sino que hace justo lo contrario: se vuelve más bello y brillante. Era, por tanto, el tinte más preciado de todos, y de hecho con el tiempo sólo reyes y emperadores podían utilizarlo, y hablar de la “púrpura real” o “púrpura imperial” se convirtió en algo común. Su producción siguió centrada en el Mediterráneo oriental incluso después de la desaparición de Tiro como ciudad independiente; los bizantinos eran grandes productores, y Carlomagno fue enterrado envuelto en tela de hilo de oro y teñida en púrpura de Bizancio.
Curiosamente la sustancia purificada y seca no huele, pero los primeros pasos para obtener la púrpura de Tiro –almacenando y triturando caracoles en un recipiente– producían un olor absolutamente repugnante, mencionado por los autores de la Antigüedad al describir el proceso. Además del olor inevitable al pudrirse los caracoles, parte del hedor se debía a algo que nadie conocía aún: la presencia de bromo en el compuesto. ¡Nadie sabía que existía!

Tela bizantina, teñida con púrpura, que envolvió el cuerpo de Carlomagno (dominio público).
Desde luego, dado el precio desproporcionado de la púrpura, muchos alquimistas intentaron dar con métodos alternativos que permitieran obtener un tinte parecido, y trataron de identificar los compuestos –hasta donde podían en una época anterior a la Química, por supuesto– que proporcionaban a la púrpura de Tiro sus propiedades. De modo que no es que no supíeramos que el bromo estaba ahí porque no estuviéramos mirando: era simplemente muy difícil aislarlo del compuesto, por su elevadísima reactividad. La púrpura permaneció como un caro, carísimo misterio.
De hecho la Edad Media pasó sin que nadie obtuviera bromo aislado, y lo mismo pasó con el Renacimiento y el Barroco. Hubo que esperar a lo que ya sabes: la fiebre del XVIII-XIX. La época en la que químicos de todo el mundo saltaban sobre cualquier cosa que pudieran para hacerle todo tipo de barrabasadas –calentarla, enfriarla, someterla a la electrólisis, exponerla a ácidos y bases fuertes– para intentar determinar su composición química y, si había suerte, la presencia de un elemento nuevo.
Curiosamente, en este caso los descubridores –porque fueron dos– no son ninguno de los grandes nombres a los que ya estás acostumbrado en esta serie, sino dos químicos mucho más modestos; de hecho el descubrimiento del bromo es el único importante que realizó uno de ellos. No trabajaban en equipo, sino que se trató de descubrimientos independientes y casi simultáneos, lo cual deja bien claro que era algo inevitable dado el avance de la Química en la primera mitad del siglo XIX.
Quien suele reconocerse como descubridor fue el francés Antoine Jérôme Balard, ya que fue quien primero publicó el descubrimiento en 1826, a pesar de que estrictamente hablando lo realizó después que el otro, el alemán Carl Jacob Löwig, que lo hizo en 1825. Esto puede parecer injusto pero tiene una razón de ser: en Ciencia se recompensa la publicación de descubrimientos, de modo que si un científico mantiene algo en secreto no recibe reconocimiento por ello. De esta manera la motivación de sacar descubrimientos a la luz es muy grande, que es precisamente el objetivo de esta medida – lo digo para que no sientas lástima por Löwig.

Antoine Jérôme Balard (1802-1876) (no he encontrado ninguna imagen de Löwig).
Irónicamente ninguno de los dos aisló bromo de la púrpura: la razón es que el bromo forma parte allí de una molécula orgánica bastante compleja, y la Química orgánica estaba aún en pañales. También resulta curioso que la fuente de bromo fuera completamente diferente para ambos, así como el método empleado para aislarlo. Como digo era algo inevitable.
El primero de los dos, Löwig, obtuvo el bromo del agua de un manantial: como decía antes los químicos atacaban todo lo que tenían a mano. El alemán saturó el agua del manantial con cloro y luego utilizó dietil éter (C4H10O), más comúnmente llamado simplemente éter, para intentar disolver cosas que hubiese en el agua y que fuesen solubles en compuestos orgánicos.
¿Por qué saturar el agua con cloro? Porque, aunque el bromo es un fuerte oxidante, el cloro lo es aún más. De modo que, al saturar la disolución con cloro, este elemento oxida al ión Br- robándole un electrón y convirtiéndolo así en Br. Estos átomos de bromo, ya neutros, se asocian para formar moléculas de Br2.
Pero claro, ahora el Br2 ya no se disuelve bien en agua, porque no es una molécula polar… pero sí se disuelve muy bien en el éter, que tampoco es polar. De manera que al final el cloro se queda en el agua en forma de Cl- con el electrón robado al bromo, y el bromo termina disuelto en el éter y listo para ser extraído de él. Y éste sigue siendo básicamente el método que seguimos empleando hoy para obtenerlo de sus sales.
Por fortuna para Löwig, el bromo es especial también en su solubilidad: normalmente hay cosas que se disuelven bien en disolventes polares, como el agua –en los que las cargas eléctricas están más bien separadas– pero no en disolventes apolares, o al revés, pero el bromo lo hace muy bien en ambos. No he conseguido sabe por qué se disuelve tan bien en compuestos apolares, pero así parece ser.
De modo que Löwig luego tomó el éter, lo dejó evaporar, y observó que quedaba un residuo líquido de color marrón y un olor muy desagradable. Al no poder identificar la sustancia, llegó a la conclusión de que tenía entre manos algo muy importante, pero no publicó sus resultados hasta pasado un año y mientras tanto Balard había hecho algo parecido y publicado el descubrimiento.
El francés obtuvo el bromo de un lugar mucho menos sorprendente: el agua de mar. Los caracoles del Mediterráneo no son los únicos seres vivos que van acumulando bromo disuelto en el agua marina a lo largo de su vida –aunque sean los que más belleza crean con él–. Balard, como Löwig, estaba buscando lo que fuera en donde fuese, y en este caso estaba examinando un alga de las marismas salobres de Montpellier.
Esta alga se empleaba ya para obtener de ella un elemento, el yodo –del que aún no hemos hablado pero se conocía ya–, pero Balard detectó allí algo nuevo además de yodo y cloro. De hecho lo que identificó el francés era algo con propiedades más o menos intermedias entre el cloro y el yodo, y muy pronto se dio cuenta de que era un elemento nuevo, con lo que se apresuró a documentar el descubrimiento y comunicarlo, bautizando el nuevo elemento con el nombre de murio por el latín muria (salmuera).
Como Balard había documentado cuidadosamente el método empleado, un grupo de químicos franceses de renombre –Joseph-Louis Gay-Lussac entre ellos– reprodujeron el experimento, obtuvieron la olorosa sustancia y confirmaron que se trataba de un elemento nuevo. Sin embargo alguien (o bien el propio Gay-Lussac o bien Anglada) propuso un nombre más a tono con el hediondo líquido: bromo, por el griego brómos (hedor). Nunca he olido bromo puro pero, la verdad, con todo esto me dan muchas ganas de hacerlo.
El bromo obtenido por Löwig y Balard era especial, además de por su aroma, porque es uno de los dos elementos químicos líquidos a temperatura ambiente (el otro es el mercurio, del que aún no hemos hablado). El líquido, que es químicamente Br2, no tiene exactamente la apariencia maravillosa de la púrpura, desde luego:

Bromo puro (W. Oelen/ CC Attribution-Sharealike 3.0 License ).
Eso sí, seguro que te recuerda a otros compuestos similares, como el yodo. Como puedes ver en el frasco, aunque a temperatura ambiente sea líquido, el bromo se evapora fácilmente, lo cual, combinado con su olor, no hace muy agradable tenerlo cerca. Aunque no es tan reactivo como el cloro, es lo suficientemente reactivo para no durar mucho tiempo expuesto a casi nada: reacciona con el oxígeno del aire, con metales, con compuestos orgánicos… con casi cualquier cosa.
Tras su descubrimiento, los químicos se dedicaron –como es natural– a intentar encontrar usos al bromo y sus compuestos. Sin embargo, para qué vamos a engañarnos, no tiene muchos: otros elementos más comunes se comportan casi igual, con lo que su descubrimiento no supuso ninguna revolución en prácticamente ningún campo. Eso sí, pronto se descubrió una propiedad muy útil de las sales de bromo, imagino que por casualidad en pruebas clínicas.
El bromuro de potasio (KBr) y el bromuro de sodio (NaBr) resultaron ser sustancias sedantes; al parecer el ión bromuro Br- interfiere de algún modo –no he logrado saber cómo– en la sinapsis, con lo que el sistema nervioso modifica su comportamiento. Dada la obsesión con el sexo de la Inglaterra victoriana, la idea inicial era que al tomar sales de bromo se inhibía el deseo sexual, lo cual es cierto, ¡igual que cualquier otro deseo o interés! Sin embargo, por ironías de la vida, incluso con esta ignorancia se consiguió cierto progreso médico.

Bromuro de potasio, KBr (dominio público).
Aunque hoy sepamos que esto no tiene sentido, en la época se pensaba que la epilepsia era consecuencia de la masturbación. Por lo tanto, dado que las sales de bromo disminuyen la libido, disminuirán también la tentación de masturbarse y, con ella, la aparición de la epilepsia. De manera que se intentó tratar la epilepsia con bromuro de potasio… ¡y el tratamiento funcionó! Los médicos de mediados del XIX pensaban que la razón era la que acabo de explicar, y que los resultados validaban esa hipótesis, pero nada de lo que he dicho tiene mucho sentido.
Lo que sucede realmente es que muchos compuestos del bromo –incluido el KBr– afectan al sistema nervioso de maneras diferentes pero relacionadas: son analgésicos, anticonvulsivos, sedantes… de manera que el éxito contra la epilepsia se debía a un simple efecto fisiológico, ya que las convulsiones disminuían por acción del ión bromuro en la sinapsis, no porque el enfermo se masturbase menos, ya que una cosa no tiene nada que ver con la otra.
De hecho a principios del siglo XX se reemplazó este compuesto con otros para tratar la epilepsia, ya que el bromo puede llegar a ser tóxico para el ser humano por encima de cierta cantidad –algo que no debería sorprenderte tras leer sus propiedades químicas–, y de hecho se han utilizado compuestos orgánicos del bromo como armas químicas aprovechando su fuerte carácter oxidante. Esto tampoco debería sorprenderte: si algo puede usarse para matar, no hay cosa que más nos guste que utilizarlo para eso.

Muestra de bromo puro (Alchemist-hp/ CC Attribution-Sharealike 3.0 License ).
Este carácter oxidante del bromo, que hace de muchos de sus compuestos muy tóxicos, también le ha dado otros usos: como desinfectante y como pesticida. El problema, por supuesto, es que los compuestos tóxicos del bromo matan así, a lo bestia, sin criterio, con lo que usarlos para fumigar es algo terrorífico. Uno de los compuestos de bromo más usados para este fin es (iba a decir era, pero se sigue usando) el bromuro de metilo o bromometano, CH3Br. Este compuesto es más tóxico aún por el hecho de contener CH3 que por contener Br, ya que el ión metilo (CH3+) es terroríficamente venenoso.
El problema del CH3Br es que, al exponerse a la luz solar, se disocia y los átomos de bromo escapan a la estratosfera, donde se unen al ozono y rompen la molécula. Sí, como lo oyes: no sólo es altamente tóxico para todo lo que se menea, sino que encima destruye el ozono estratosférico. Vamos, una joya de molécula cuya producción en 1999 rondaba las 72 000 toneladas anuales. Afortunadamente parece que está disminuyendo su uso.

Extintores de bromuro de metilo (dominio público).
Curiosamente, el bromuro de metilo tiene otras propiedades útiles, aunque ninguna hace que merezca la pena usarlo después de lo que acabo de contar, claro. A principios del siglo XX se descubrió que podía emplearse en extintores, en situaciones en las que no puede utilizarse el agua ni muchos otros compuestos polares ya que hay cables eléctricos y cosas así. Entre 1920 y 1960 se fabricaron extintores de CH3Br, pero la cordura ha acabado ganando y ya no se usa para este propósito, porque otras moléculas mucho más seguras, baratas y menos perjudiciales hacen básicamente lo mismo.
Ahora bien, el bromuro de metilo no es el único compuesto orgánico de este elemento que funciona muy bien para extinguir llamas o, al menos, ralentizar la combustión. De hecho, aunque te sorprenda, casi toda la producción mundial de bromo actual (más de medio millón de toneladas anuales) va destinada a este fin. Aunque se utilizan moléculas menos terroríficas que el CH3Br, sospecho que poco a poco dejarán de emplearse y se irán sustituyendo por otras inertes: al fin y al cabo es difícil tener una molécula orgánica con iones de bromo que no sea tóxica de una manera u otra en concentraciones elevadas.
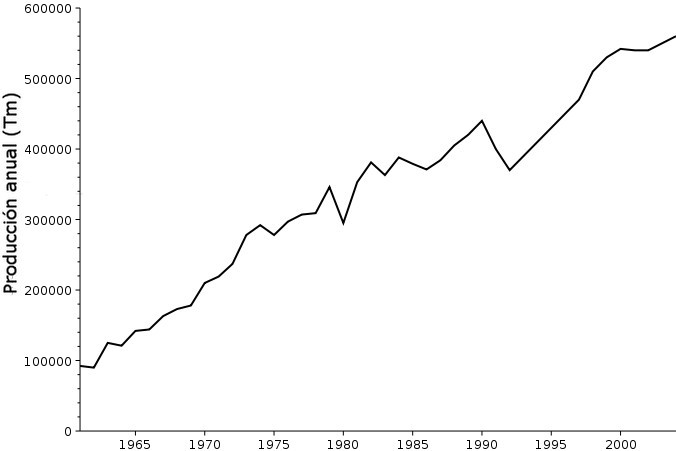
Evolución de la producción anual de bromo (dominio público).
Casi todo el bromo que producimos, por cierto, lo obtenemos del lugar más lógico: el mar. En las salinas se obtienen muchas sales marinas diferentes, y entre ellas el bromuro de potasio y el bromuro de sodio. De un modo parecido al de Löwig y Balard, se tratan estas sales con iones cloruro –más “hambriento” aún que el bromo de los electrones donados por el metal– y así se obtiene bromo puro. Pero, aunque la gráfica muestre un crecimiento aparentemente imparable, sospecho que en un momento dado se invertirá la tendencia – salvo que descubramos alguna otra propiedad del bromo que lo haga indispensable, por supuesto.
Puede que te estés preguntando entonces, ¿es que ya no lo usamos como tinte de ninguna manera? Pues sí, la verdad es que sí lo hacemos, aunque no del mismo modo que antes. No sé cuánta púrpura imperial se sigue produciendo hoy en día, pero los compuestos de bromo que utilizamos actualmente como tintes son mucho menos espectaculares pero muchísimo más útiles y sofisticados.
El azul de bromotimol, una molécula bastante pesada con dos átomos de bromo (C27H28Br2O5S) es un indicador muy sensible a cambios en el pH, con lo que se utiliza en química precisamente con ese fin. Se emplea especialmente en situaciones en las que el pH es prácticamente neutro, donde otros indicadores tal vez no cambiarían apenas de color, ya que el azul de bromotimol lo hace muy fácilmente.

Azul de bromotimol en medios ácido, neutro y básico (dominio público).
Pero el tinte de bromo más útil de todos ni siquiera lo es en el espectro visible: se trata del bromuro de etidio (C21H20BrN3), que presenta una intensa fluorescencia al ser iluminado con radiación ultravioleta. Dicho mal y pronto, cuando absorbe radiación ultravioleta el bromuro de etidio brilla con una luz anaranjada.
Esto no es inusual, ya que es un fenómeno que sufren muchas otras moléculas, pero ésta es muy especial – su brillo se multiplica por veinte cuando se ha unido a una cadena de ADN –algo que hace con bastantes ganas–. De manera que se utiliza para “marcar” ADN en el laboratorio. El problema es, ¡sorpresa!, que es altamente tóxico, pero como se usan cantidades pequeñas y en un entorno controlado, en este caso las ventajas sobrepasan con mucho a los inconvenientes.

Bromuro de etidio unido a ADN y sometido a radiación UV (Transcontrol/ CC Attribution-Sharealike 3.0 License ).
Es una belleza diferente de la púrpura imperial con la que empezamos, pero sigue siendo algo bellísimo – y, en este caso, crucial para el avance de la biología. Yo me quedo con el bromuro de etidio antes que con la púrpura de Tiro.
En la próxima entrega de la serie hablaremos del elemento de treinta y seis protones. Como el bromo estaba a punto de tener una configuración electrónica estable, estudiaremos un elemento que ya lo es: el kriptón.
Para saber más: