Nota: Como sigo malo y no puedo escribir mucho, combinaremos febrero y marzo en un único número de compilación, de modo que no os preocupéis cuando no llegue febrero. ¡Lo siento!
Seguimos hoy nuestro viaje por la tabla periódica en Conoce tus elementos. En la última entrega de la serie hablamos sobre el elemento químico de 37 protones, el rubidio. Hoy lo haremos, por tanto, del elemento de 38 protones, otro metal muy reactivo: el estroncio.
Se trata de uno de esos elementos que cumplen una propiedad para ser descubiertos pronto, pero no la otra: es muy abundante en la corteza terrestre, pero no se encuentra puro jamás. Por lo tanto, es uno de esos “elementos escondidos”, con los que hemos convivido durante toda nuestra existencia en el planeta sin saber que estaban ahí. De hecho, como veremos luego, lo de convivir no es una manera de hablar: el estroncio es una parte de tu propio cuerpo.
Al tener 38 protones, el estroncio se encuentra en la tabla periódica justo por debajo del calcio y por encima del bario. Es, por lo tanto, un metal alcalinotérreo cuya tendencia natural es librarse de dos electrones para alcanzar la estabilidad electrónica. Dicho de otro modo, su estado de oxidación más común es +2.
En cuanto el estroncio entra en contacto con el oxígeno del aire, se oxida para formar óxido de estroncio (SrO), de modo que es imposible tenerlo puro al aire libre. Ya hemos hablado antes de muchos otros metales que hacen lo mismo. Otro alcalinotérreo, el magnesio, se usó durante años de este modo para hacer de flash en las cámaras de fotos antiguas, ya que la oxidación es tan rápida que es una combustión.
Bien, el estroncio es mucho más reactivo con el oxígeno que el magnesio: en el caso del segundo, hacía falta una chispa para iniciar la oxidación. El estroncio pulverizado arde espontáneamente en el aire. Esto te da una idea de lo difícil que es encontrarlo puro. De hecho, reacciona con casi cualquier otro elemento que esté dispuesto a aceptar electrones, de manera que en la Tierra sólo se encuentra asociado en forma de moléculas, sobre todo en rocas.
Pero, como decía al principio, hay bastante estroncio en la corteza: ocupa el lugar número 16 en abundancia entre el carbono y el azufre, con una concentración de unas 360 partes por millón. De modo que, según nuestra capacidad de discernir elementos fue avanzando, era inevitable que lo encontráramos. Seguro que adivinas cuándo sucedió: en la fiebre del siglo XVIII, aunque no lo aislamos hasta principios del XIX. Y la historia hace que éste sea el tercer elemento que hemos visto, junto con el cobalto y el níquel, que incluye el nombre de una criatura feérica.
En 1722 se descubrió galena cerca de un pueblo del oeste de Escocia llamado Strontian. La galena es un mineral compuesto fundamentalmente por sulfuro de plomo (II) (PbS), y es de gran importancia por ser la principal fuente de plomo de la que disponemos. De modo que se abrieron minas en Strontian para extraer galena.

Sròn an t-Sìthein, Strontian [Peter Van den Bossche / CC Attribution-Sharealike 2.0 License].
El nombre del pueblo en gaélico escocés, por cierto, de donde derivó Strontian en inglés, es Sròn an t-Sìthein, que significa algo así como La nariz de la colina de las hadas, del gaélico sídhe (hada). De ahí vendría luego el nombre del estroncio, que por tanto tiene parte de nariz y parte de hada. Pero no me quiero ir más por las ramas.
Como sucedió con tantas otras minas, la de Strontian proporcionó a los químicos del XVIII rocas que examinar en busca de nuevos elementos. Además de galena, las minas de Strontian extraían otros minerales, entre ellos un carbonato parecido a otros conocidos, como el carbonato de calcio (CaCO3). Cuando el químico y médico Adair Crawford examinó ese carbonato junto con su colega William Cruickshank en 1790, descubrió que tenía propiedades sutilmente diferentes de otros carbonatos de las tierras alcalinas ya conocidas, como el calcio y el bario.
Hoy en día sabemos que esa roca, que llamamos estroncianita, es realmente carbonato de estroncio (SrCO3), similar al de bario o calcio pero, efectivamente, de propiedades ligeramente distintas por tratarse del carbonato del elemento que está justo entre los otros dos.

Estroncianita procedente de Strontian [Rob Lavinsky / CC Attribution-Sharealike 3.0 License].
Crawford y Cruickshank concluyeron que muy probablemente existía en ese mineral un elemento nuevo, pero fueron incapaces de aislarlo de la roca. Otros químicos de los años posteriores confirmaron la existencia de un nuevo elemento en la estroncianita, pero tampoco lograron aislarlo – no bromeaba cuando decía que el estroncio tiene una verdadera obsesión con librarse de esos electrones y aferrarse con uñas y dientes al elemento que los acepta.

Sir Humphry Davy (1778-1829) [dominio público].
Hacía falta un genio experimental con años de experiencia aislando elementos a sus espaldas para obtener el misterioso componente de la roca de Strontian: Sir Humphry Davy lo consiguió en 1808. Primero Davy obtuvo un compuesto diferente del elemento usando métodos puramente químicos, cloruro de estroncio (SrCl2). Luego lo mezcló con óxido de mercurio (II) (HgO), y sometió la mezcla al proceso de la electrólisis: en uno de los electrodos se depositó lo que era evidentemente un metal.
Davy denominó al elemento strontium (estroncio) en honor al lugar en el que se había observado por primera vez. El inglés no obtuvo al principio grandes cantidades del metal, y como he dicho antes es imposible que dure mucho tiempo puro al aire, pero ésta es su apariencia inusual y muy bella:

Estroncio puro [Alchemist-hp / Free Art License].
Esa muestra, por cierto, está en un recipiente hermético lleno de argón, un gas inerte, de modo que no se oxide. Además de reaccionar rápidamente con el oxígeno, también lo hace con el agua para producir hidróxido de estroncio e hidrógeno molecular:
Sr + 2H2O → Sr(OH)2 + H2
Aquí puedes ver una reacción de ese tipo (aunque el estroncio de la muestra tiene la superficie oxidada, por eso ya no tiene el color dorado original):
A diferencia de otros metales similares, muy reactivos y por lo tanto inútiles como elementos estructurales, el estroncio encontró rápidamente un uso práctico sorprendente: la producción de azúcar de remolacha.

Cosecha de remolacha azucarera [4028mdk09 / CC Attribution-Sharealike 3.0 License ].
Para extraer el azúcar de la melaza obtenida de la remolacha, dos franceses, Hippolyte Leplay y Augustin-Pierre Dubrunfaut, desarrollaron un proceso que involucraba el carbonato de estroncio para extraer una cantidad de azúcar mayor que nunca del tubérculo. Un alemán, Carl Scheibler, perfeccionó el método hasta convertirlo en algo fundamental en la industria azucarera de finales del XIX y principios del XX.
Lo bueno del proceso es que el carbonato de estroncio, como un catalizador, se recuperaba al final del proceso, de modo que el consumo de este elemento no era exagerado. Sin embargo, siempre hay pérdidas en cualquier proceso industrial, de modo que la demanda de estroncio para producir azúcar fue enorme durante décadas: la casi totalidad de su producción mundial en el cambio de siglo se empleaba con ese propósito.
Posteriormente se encontraron otras formas de extraer los azúcares más eficaces, y hoy en día una gran cantidad del azúcar se obtiene de la caña de azúcar y no la remolacha. Sin embargo, según el papel del estroncio en la producción de azúcar fue perdiendo importancia, la ganó en otro campo diferente pero también sorprendente: la televisión.
Hasta hace relativamente poco, los televisores y los monitores de ordenador empleaban tubos de rayos catódicos para producir la imagen. Seguro que los conoces (aunque a veces no me doy cuenta de lo viejo que soy): los televisores de gran profundidad, que acumulan estática en la pantalla.

Tubo de Goldstein, uno de los primeros tubos de rayos catódicos.
Ya hemos hablado aquí muchas veces de los rayos catódicos, por ejemplo al hacerlo de Johannes Stark, y en el caso de esos televisores el tubo dispara electrones contra la pantalla, y emplea campos magnéticos para dirigir los electrones a la zona de la pantalla que se desea. Allí los electrones impactan contra ella desde dentro y producen la imagen. No voy a entrar aquí en mucho detalle, porque no es el propósito de este artículo.
Lo importante es que cualquier carga eléctrica que sufre una aceleración o deceleración emite radiación electromagnética, tanta más cuanto mayor sea esa aceleración y mayor la carga. Así, las máquinas de rayos X de los hospitales disparan electrones contra un metal y, al frenarse bruscamente, los electrones emiten radiación muy energética: rayos X.
Bien, en el caso de los televisores CRT (es decir, de tubo de rayos catódicos, por las siglas en inglés), los electrones también son frenados bruscamente y emiten radiación muy energética: entre otras cosas, rayos X. Pero claro, en este caso se trata de un efecto no deseado y es absolutamente fundamental proteger el exterior del aparato de esa radiación ionizante. Por eso el tubo está recubierto de compuestos con plomo, que absorbe muy bien los rayos X.

Tubo de rayos catódicos de una pantalla [Blue tooth7 / CC Attribution-Sharealike 3.0 License].
Pero el cristal de la pantalla no puede estar recubierto con plomo, porque debe ser transparente. Muy pronto los ingenieros se dieron cuenta de que el bario y, sobre todo, el estroncio, formando parte del vidrio, actuaban como escudo que absorbía muy bien la radiación X pero dejaba pasar la luz. Algo ideal: en el visible, el vidrio es transparente, pero los rayos X no pueden salir.
Este renacimiento del estroncio como componente de las televisiones, tras haber sido protagonista con la remolacha, duró también unas cuantas décadas, pero está decayendo. La razón es que apenas se usan ya tubos catódicos en monitores y televisiones, aunque sigue suponiendo las tres cuartas partes del consumo mundial de estroncio. Claro, esto se debe en parte a que no tenemos apenas otros usos que lo consuman en gran cantidad.
Un 5% se emplea en fuegos artificiales: el carbonato de estroncio, así como otras sales, arden con una llama de un rojo muy intenso. Por eso se añade a los fuegos artificiales para darles ese color, aunque por supuesto no se trate de una cantidad muy grande incluso a nivel mundial.

Fuegos artificiales con rojo de estroncio [Vojta Jahoda / CC Attribution-Sharealike 3.0 License].
El mayor productor actual, por cierto, no es Strontian, ni siquiera Escocia: es China, seguida de España y México. Tampoco se extrae fundamentalmente de la estroncianita en la que lo encontramos por primera vez, sino de la celestita, que es sulfato de estroncio (SrSO4). A partir de ella se produce carbonato de estroncio, que a veces se usa directamente –como en los fuegos artificiales– y otras para obtener estroncio metálico.

Celestita (SrSO4), la principal fuente de estroncio [dominio público].
Aunque no se trate del uso de estroncio procedente de minas, este elemento tiene otra utilidad que tiene que ver con dos propiedades: una, su papel biológico, y la otra, la existencia de varios isótopos naturales. De modo que vamos con cada una de las dos.
El estroncio no tiene un papel importante en casi ningún ser vivo: es tan similar al calcio químicamente hablando, y ese elemento es tan abundantísimo, que su presencia o ausencia importa poco. El único ser vivo que lo emplea específicamente es una clase de radiolarios, Acantharea, que utiliza el sulfato de estroncio (SrSO4), el mismo que forma la celestita, para construir su esqueleto.
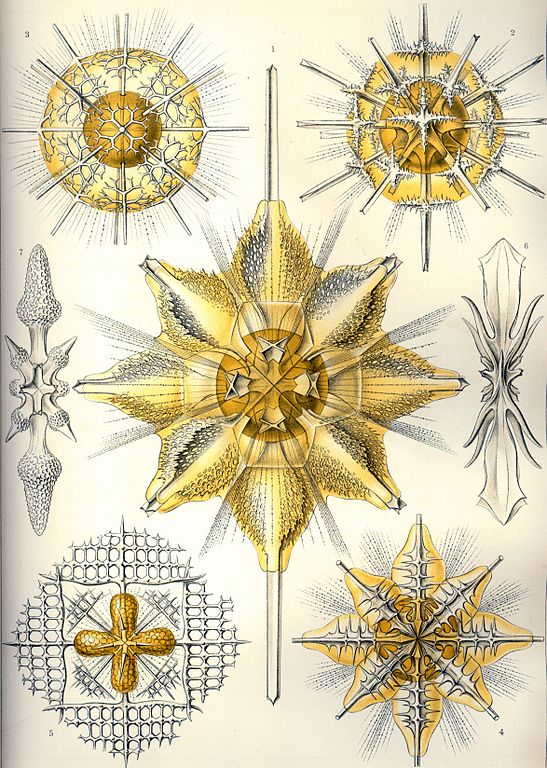
Esqueletos de Acantharea [dominio público].
Lo que sí sucede, por la misma razón de su similitud con el calcio más abundante, es que los seres vivos lo absorbemos y empleamos casi indistintamente. Dado que hay mucho más calcio que estroncio, por supuesto, nuestro cuerpo contiene mucho más del primero que del segundo, pero algunos átomos de tus huesos son de estroncio en vez de calcio. La fracción varía, pero oscila entre 1:1000 y 1:2000.
Esto se hace más interesante por la presencia de isótopos diferentes. El estroncio terrestre existe en cuatro isótopos diferentes, estroncio-84, estroncio-86, estroncio-87 y estroncio-88. Todos ellos tienen 38 protones –o no serían estroncio–, pero el primero tiene 46 neutrones, el segundo 48, el tercero 49 y el cuarto 50.
De los cuatro, uno es especial: el estroncio-87 es el único que es producto de la desintegración de un isótopo inestable, el rubidio-87, que tiene una semivida de unos cuantos miles de millones de años. Por lo tanto, una pequeña parte del estroncio terrestre no ha estado aquí siempre, sino que se ha ido produciendo poco a poco a raíz de la desintegración del rubidio.
Por lo tanto, conociendo la fracción del estroncio de una roca que es estroncio-87 puede saberse si esa roca tuvo en el pasado más o menos rubidio, y dado que esto depende del origen geológico y geográfico de la roca, el porcentaje de estroncio-87 es una especie de “huella dactilar” para ella.
Pero claro, los seres vivos –incluyendo a los seres humanos– incorporan estroncio en sus huesos en lugar del calcio, aunque sea en pequeña cantidad. Y las proporciones de cada uno de los isótopos de estroncio que hay en nuestros huesos dependen en cierta medida de la región geográfica en la que se formó ese hueso. Digo “en cierta medida” porque hoy en día los alimentos viajan tanto que el estroncio que consumimos oculto en el calcio puede venir de otros lugares, pero sigue siendo útil para analizar migraciones de hace muchos años.
Por otro lado, esta absorción de estroncio por nuestro organismo, “confundiéndolo” con calcio, tiene un problema. El estroncio-90 es un isótopo inestable de este elemento, que tiene una semivida de unos 30 años. Por lo tanto, no queda nada en la Tierra de lo que pudiera haber habido antes… excepto el que producimos nosotros.
¿Cómo lo producimos? Es uno de los productos de la fisión de elementos pesados. Esto significa que, si explota una bomba nuclear de fisión –y hemos hecho explotar varias a lo largo del siglo XX– o se expone el núcleo de una central de fisión al aire –y esto nos ha sucedido también en Chernobyl–, se libera estroncio-90.
Pero claro, ese estroncio-90 es estroncio al fin y al cabo, y tiene una semivida de décadas. Por lo tanto, entra en el ciclo del calcio, termina siendo absorbido por plantas, luego animales, y también por nosotros. Y, a diferencia de otros isótopos inestables que puedan entrar en nuestro cuerpo, el estroncio-90 se queda, ¡porque acaba formando parte de nuestros huesos!
El resultado es un isótopo inestable, que terminará desintegrándose en el hueso y liberando partículas muy energéticas y radiación ionizante. De hecho el estroncio-90 es uno de los emisores de radiación beta (electrones muy energéticos) de larga vida mejores que conocemos. Pero claro, tener un “excelente emisor de radiación beta” en los huesos no es muy recomendable. Por eso en este caso la combinación de su papel de pseudo-calcio con la inestabilidad nuclear es un problema.
Fuera de eso, dado que es tan similar al otro metal, el estroncio no supone ningún problema para nosotros. De hecho, algunos estudios sugieren que esa pequeña cantidad en nuestro organismo puede ser incluso beneficiosa y los osteoblastos (las células que producen el tejido óseo) son más eficaces cuando disponen de él.
Tras un elemento razonablemente raro, en el siguiente artículo conoceremos uno que lo es aún más: el elemento de 39 protones, el itrio. ¡Hasta entonces!